錯滴定の原理
錯生成反応を利用することで、金属イオンを滴定する方法を錯滴定という。
特にキレート試薬を用いるキレート滴定は一般に広く知られており、その中でもエチレンジアミン四酢酸(EDTA)を用いるEDTA滴定はよく知られている。
ただし、全ての錯生成反応が錯滴定に適しているわけではない。錯滴定に用いりやすい錯生成反応としては、以下のような条件を満たすものが挙げられる。
- 金属イオンと滴定試薬が1:1の錯体を形成する
- 錯滴定に対して、充分に大きい錯生成定数をもっている
- 錯生成の反応速度が充分に大きい
反応速度が大きいものが錯滴定に適している理由は、反応速度が小さい場合は、滴定に長い時間が必要になり、終点の判断も難しくなるからである。
金属イオンと滴定試薬の反応の比率と、大きい錯生成定数が重要な理由について、具体例を考えてみる。
金属イオンMと配位子Lが1:1の錯体を形成する場合と、1:3の錯体を形成する場合を検討する。
全錯生成定数は、1:3の錯体については
とする。
1:1の錯体を形成
1:3の錯体を形成
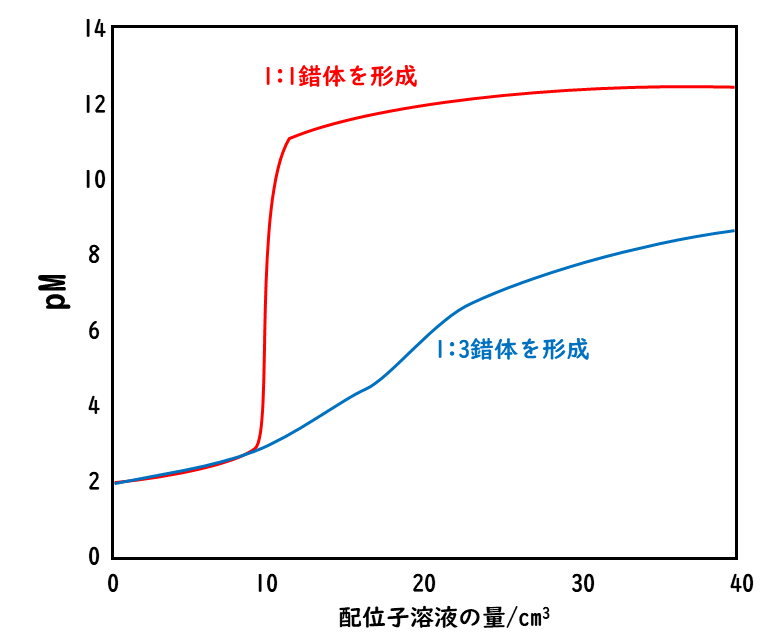
1:1錯体形成の場合と、1:3錯体形成の場合の滴定曲線の概略図は上のようになる。ここでは、金属イオンの試料溶液を10 cm3、金属イオンの総濃度を0.020 mol/dm3、配位子溶液の配位子の濃度を0.020 mol/dm3としている。
1:1錯体形成の場合は、当量点付近で大きなpMのジャンプが起こる。錯滴定では、このpMのジャンプを検出することで、金属イオンの濃度を求めることができる。この場合、約108以上の生成定数が必要である。
一方で、1:3の錯体形成の場合には、PMは当量点である30 cm3の前からだらだらと変化していき、当量点でもPMの大きな変化は観測されない。この原因は、当量点前に滴定試薬の量が金属イオンMに比べて多くなり、低次の錯体MLの生成によってLと結合していないMの濃度が滴定の初期段階から減少してしまうことである。
この1:3錯体のようなの変化は1:2錯体や1:4錯体でも起こる。そのため、錯滴定には1:1錯体を生成できるキレート試薬が適している。