配位結合
錯体化学において重要な要素の1つが、配位結合である。
分子結合を形成する共有結合は、結合に関与する原子がそれぞれ電子を1つずつ出して電子のペアが形成され、この電子のペアによって結合ができる。
この共有結合は、ルイスが提唱し、そして現在でも、化学を考えるうえでの基礎的な概念となっている。
一方で、配位結合は、共有結合のように2つの原子から1つずつ電子を共有するのではなく、ある原子の軌道から1対の電子(ローンペア)を出し、相手原子となる原子の空の軌道を占有することによって形成される。そして、錯体化学は、この配位結合の形成という概念を考える必要がある。
配位結合は、電子対を出すアクセプター (Aで表す)と、電子対を受け取るドナー (Dで表す) の間の配位結合を、簡単な式で表すと下のようになる。(電子対は:で表す)
A + :D → A:D
他にも矢印によって電子供与の方向を示すために、生成物をA←:DやA←Dのように表すこともできる。また、電子対を表す:を使わずにADと表すこともできる。
ちなみに実際の分子では、配位結合と通常の共有結合は区別がつかない。しかしながら、配位結合が壊れた場合には、アクセプターに孤立電子対が残るというように、多くの配位結合は可逆的であると考えることも一般的である。
多くの錯体は、配位結合によって、1つの原子やイオン、原子群が結合しているが、その中心となっている原子やイオンを考えて、特定することができる。この中心原子は、アクセプターであり、少なくとも1つの孤立電子対をもっている。中心原子は金属や半金属であることが多い。
半金属の場合は、配位共有結合の形成は中心原子に結合する基や原子の数の増加と関連している。そのため、ドナーとアクセプターの考えに基づく、電子の数の計算によって、形成される配位結合の数を考えることができる。
しかしながら、金属イオンの場合は、単純な数の計算のモデルは適用できないことが多い。これは、錯形成によって生成する新しい結合の数と、金属イオンの電子対を受け入れることができる見かけの空軌道の数が、必ずしも一致しないからである。特にこういった現象は、各結合それぞれの配位結合の形成によるエネルギーの安定化よりも、全体として考えた時の配位結合の形成のエネルギーの安定化のほうがより安定する場合などに起こりやすい。
また、中心原子2つ以上存在する大きな錯体も存在する。
一方で、電子対を供与され、中心原子に配位する原子群などはリガンドといわれる。リガンドはF-のような単原子イオンのように小さいものから、ポリマーのように大きいものまで存在する。有機分子の多くも、リガンドとして機能するか、リガンドとして機能する分子に変換することができる。この中でも、特に電子対を提供する原子をドナー原子などという。ドナー原子の特徴としては、電機陰性であることが多く、N、O、S、Pなどのヘテロ原子やハロゲン化物イオンであることが多い。
そして、この配位結合が関与し、生じる化合物を錯体という。
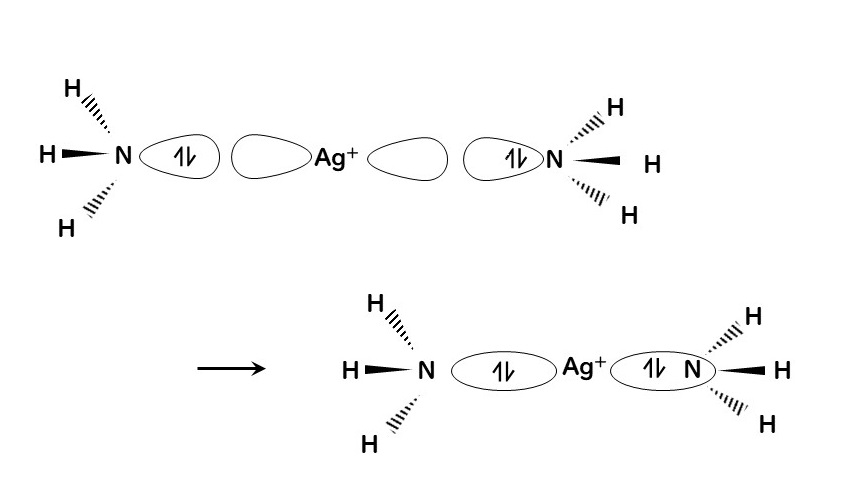
非共有電子対を1つもつアンモニアは典型的な配位子 (リガンド) である。ちなみにアンモニアのNがドナー原子である。同様にカルボアニオン-CH3も、アンモニアと等電子的であり、配位子とみなすことができる。他にも水素化物イオンH-も、一対の電子をもつことから配位子として作用することができる。
このドナー原子に重要な要素は、ドナー原子の種類ではなく、ドナー原子の電子対を供給する能力である。
金属錯体と混成軌道の形成
金属錯体は、空の軌道をもつイオン、原子、分子と、孤立電子対をもつ原子またはイオンによる配位結合によって形成される。この金属錯体では八面体形状は一般的な形状である。ここでは同じ八面体形状である陰イオンの化合物として、SiF62-を示す。
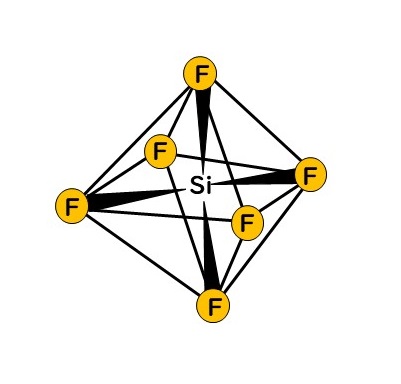
中心のケイ素は周期表では、炭素の下に位置している元素であり、化学的な性質にも類似点がある。しかしながら、炭素ではよく使われる原子価結合理論やオクテット則が、そのまま当てはまらない。
SiF62-は中心にSi4+イオンが存在する。Si4+イオンは、イオンになる際に4つの価電子が失われている。この価電子が無くなったことによる空軌道に、各フッ化物イオンF-の電子対が配位結合している。
このイオンを考えるには、さらに軌道の混成を考慮する必要がある。この形状の生成には、ケイ素の1つの3s軌道、3つの3p軌道、5つの3d軌道のうち2つの軌道の混成によるsp3d2混成を考える。この軌道が、それぞれの電子対が最も離れた配置をとるために八面体の6つの角に配置されると考えると八面体の形成ができる。
当然混成して形成する軌道が異なれば、得られる形状も異なる。1つのs軌道と3つのp軌道の組み合わせで形成されるsp3軌道は四面体となる。sp混成軌道の場合は線形、sp2軌道の場合は三角平面形状となる。
こういった配位結合の形成と形状の考え方は金属イオンも類似しているが、金属イオンはd軌道に電子が存在するため、その点を考慮する必要がある。また、実際の形状は、中心原子やリガンドの性質も影響する。
こういった分子の形状は、錯体の物理的特性にも影響を与えるため、非常に重要となる。