金属元素について
錯体は金属イオンと配位子で構成されることから、錯体において金属は重要な要素である。
元素周期表を見ると、元素の大半は金属である。また、研究者によって新たに作られ、確認される新元素も金属であるため、全元素における金属の割合は増加していくとも考えることができる。
周期表上での元素の位置は、電子配置に依存する。そして、よく知られているように各元素の化学的な性質は、元素周期表上の元素の位置によって、それぞれ特徴がある。
例えば、s、p、d、fブロックの金属は共通の性質がある。通常は、金属は陽イオンを形成し、他のイオンや分子と結合して、分子配位錯体となることが多い。
自然中の金属元素と錯体中の金属元素
通常、金属が存在する自然の地殻中では、金属がとっている酸化状態は、ほぼ限られている。例えば、地殻中では、ほぼすべてのアルミニウムはAl(III)で存在している。鉄にはFe(II)とFe(III)の両方でが一般的に存在しているが、Fe(IV)などで存在していることは非常にまれである。
レニウムは、高酸化状態のRe(VI)で存在していることが一般的であるが、Re(III)やRe(II)で存在していることは非常にまれである。
このように、金属元素はどの高酸化状態や低酸化状態で存在するかは、様々であるが、各金属元素がとる通常の酸化状態があり、他の酸化状態で存在していることは、まれである。
しかしながら、錯体の場合には、金属イオンに結合している基や原子によっては特殊な環境が存在し、珍しい酸化状態で存在することになる。これは金属に配位する基と、金属が維持できる酸化状態との間に、非常に密接な関係が存在しているからである。
つまり、錯体は、その配位子などが形成する特殊な環境によって、金属もまた特殊な酸化状態をとる可能性があり、これが錯体では新たな機能を発現させる可能性の要因の1つであり、錯体を研究する重要性にも繋がっていると考えられる。
金属元素の酸化状態
例えばdブロックの最初の行の元素の酸化状態を表にまとめると以下のようになる。
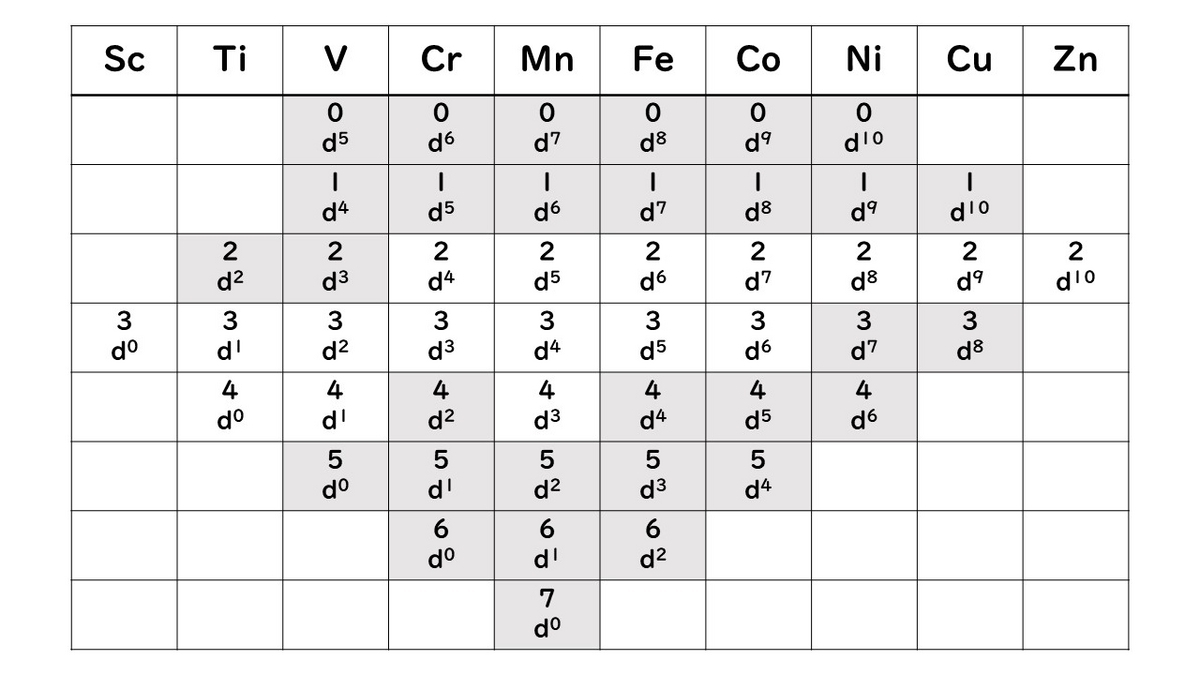
背景が灰色の箇所は、どちらかというと特殊な酸化状態ということができる。つまり酸化状態2と酸化状態3が存在することが最も一般的である。特に酸化状態が3を超えるものは、水和遷移金属イオンは水中で安定に存在しないため、より高い酸化状態の種には必ず水以外の他の配位子が関係している。
ほとんどの金属は豊富な酸化状態を取ることがあり、その酸化状態の限界は大きく2つ考えられる。1つはd電子がなくなり、d0配置になる場合である。もう1つは、イオンの安定性が大きく損なわれるほど高い還元電位になる。つまり、金属をより低く、一般的に安定する酸化状態に戻る酸化還元反応が即座に起こり、実際には存在できない状態である場合である。
周期表を左から右に見ていくと、d電子の数が増加するため酸化状態も多くなる。しかしながら、原子核の電荷による遮蔽が減少することの影響もあるため、すべてのd電子を活用することは大変困難となる。
標準還元電位(E0)は、特定の酸化状態における金属の安定性の尺度となる。E0は標準水素電極(SHE)と結合した半電池で生成される電圧である。そのため、この半電池電位は0.0Vと定義されている。つまり、E0が正であればあるほど、金属にとっては水和金属イオンへの金属酸化が起こりにくくなることを意味する。または、E0の正の値が低いほど、金属はその対の基などと、より高い酸化状態でより安定し、その結果、より低い酸化状態に還元されにくくなると言うこともできる。
金属の活性は、水などのプロトン性溶媒や水素イオンとの反応性に関係しており、電気陰性度とも相関している。非常に電気陽性の金属(陽イオンの還元電位が-1.6V)は電気陰性度が低くなる。これらには、sブロックとすべてのランタニド金属が含まれる。電気陽性金属は陽イオンの還元電位が最大で約0Vまでであり、dブロックの第一行と一部のpブロック元素が含まれる。電気陰性金属は陽イオン還元電位が正であり、dブロックの2行目と3行目のほとんどが含まれている。
酸化還元過程における反応性は、これらの区分ごとに異なる。例えば、電気陰性金属は、電気陽性金属とは異なり、酸素によって腐食されることはない。
配位子供与基の数について
他に、金属イオンを含めて共通性を定義する方法としては、中心金属に結合できる配位子供与基の数を考えることができる。ただし、化学の研究が進むことによって、存在することができる金属の配位数への理解も深まり続けている。
例えば、コバルト(III)は数十年前では、中心金属イオンに結合しているドナー基や原子は必ず6個、つまり配位数は6であると考えられていた。この配位数は、この酸化状態のコバルトでは一般的な配位数である。しかしながら、現在ではCo(III)の配位数が5、や4でありながら安定している例もある。Co(II)としての他の一般的な酸化状態では、4と6の2つの配位数がある。別の金属イオンであるCu(II)においても、5配位が、4配位や6配位と同様に一般的になるように知識がアップデートされており、一般的と一般的でないとの定義が化学の進歩によって変わり、また過去の文献とは一般的の定義が異なることがある場合もある。