遷移元素または遷移金属、は中性および陽イオン状態で不完全なd殻、またはf殻を有する金属元素である。これらの遷移元素はScからCuまでの3d元素、YからaGまでの4D元素、HfからAuまでの5d元素のdブロック元素がひとまとめになり、LaからLuまでのランタノイド元素、AcからLrまでのアクチノイド元素はfブロック元素に分類される。また、Sc、Yはdブロック元素だが性質はランタノイド元素に似ている。
この記事では特にdブロック遷移金属の錯体について取り扱う。
錯体とは
中心の原子もしくはイオン(金属イオンの場合が多い)のまわりに、特定数の原子、分子、イオン(配位子)が結合している化合物を錯体という。
ただし典型的なイオン結合や金属結合の化合物は錯体とはいわない。
ウェルナー錯体と非ウェルナー錯体
錯体はウェルナー錯体と非ウェルナー錯体に大きく分けられる。
アンミン錯体やアクア錯体などのウェルナー錯体の配位結合は主に配位子のσ電子の供与によって起こり、結合の安定化エネルギーは中心金属のd軌道と相互作用する配位子σ軌道の安定に由来している。一般的に中心金属原子の価数が大きいものに見られ、常磁性化合物が安定に存在する。
ウェルナー錯体とは異なるカルボニル錯体やアリル錯体などの錯体は非ウェルナー錯体といわれる。いずれも金属-炭素間結合を少なくとも1つもっている。そして非ウェルナー錯体は結合が中心金属原子のd軌道と配位子の反結合性π軌道の重なりにもとづく逆供与による部分が強いとい特徴がある。
中心の原子またはイオンの数によって一核(単核)錯体、二核錯体(複核錯体)、二核以上を多核錯体という。
中心金属
錯体の中心金属の半径は配位数と関係がある。
dブロックの遷移金属の性質は第1周期金属(3d)と第2周期金属(4d)では大きく異なるが、第2周期金属(4d)と第3周期金属(5d)の差は小さい。
スカンジウムから銅の金属半径(166 ~ 128 pm)はイットリウムから銀 (178 ~ 144 pm) およびランタンから金(188 ~ 146 pm)に比べて、相当小さい。そのため第1周期金属化合物は6配位以上になるのは困難である。
第3、3周期金属では7~9配位をとることがある。ランタンのあとにセリウム(182 ppm)からルテチウム (175 pm)までが入るが、ランタニド収縮によって半径が小さくなっていくため、第2、3周期の金属半径はほとんど同じである。
第2、3周期金属では高酸化数の状態が第1周期金属に比べ、はるかに安定である。第1周期金属の高酸化状態化合物は酸化剤として協力であり、自身は容易に還元される。一方、第1周期金属では2価、3価の化合物は一般的に存在するのに対して、第2、3周期金属では必ずしも一般的ではないという特徴がある。
また第1周期遷移金属にも金属-金属結8号を有する低酸化数の金属カルボニルクラスター化合物があるが、ハロゲン化物、硫化物では金属ー金属結合を有するクラスターは少なくなる。
一般的に金属-金属結合は3d金属よりも4dや5d金属のほうが形成しやすい。
このように遷移金属は同じ族の金属でも第1周期とそれ以下の周期のものは化学的性質が大きく異なる。
dブロック遷移金属の性質は周期表の上下で大きな違いがある一方で、左右でも顕著な違いがある。左側の3~5族の金属を前周期遷移金属と呼ぶこともあり、これらは親酸素性、親ハロゲン性である。その理由は金属の電子数が少なく、硬い金属であるため、硬い元素である酸素やハロゲンに結合しやすいというHSAB則の考え方で考えることができる。架橋配位子が無い場合、金属-金属結合は形成しにくい。一方で、これらの金属の有機金属化合物は、炭化水素化合物中のC-H結合の活性化能が高いことも知られている。周期表の右側の後周期遷移金属は柔らかく、硫黄やセレンに対する親和性が高い。
dブロック遷移金属の軌道はs軌道、p軌道、d軌道があるが、d軌道に電子がn個あるイオンはdn構造イオンのように表されることも多い。例えば、「Co3+はd6イオン」のように使われる。また配位子場により分裂した軌道の電子数も軌道の記号に上付きの数字で表され、t2g軌道に3個の電子が入っている場合は「t2g3」のように表記されることが多い。
配位子
金属イオンに配位子が配位した化合物が金属錯体である。配位子の大部分は中性配位子と陰イオン性配位子であるが、陽イオン性配位子も存在しないわけではない。一酸化炭素)CO)のような中性配位子は、金属に配位しなくても独立な分子であるが、一方でCl-のような陰イオン性配位子は中心金属に配位することによって安定化する。
化学式が複雑な配位子や、よく使われる配位子は略号などがつけられているケースもある。
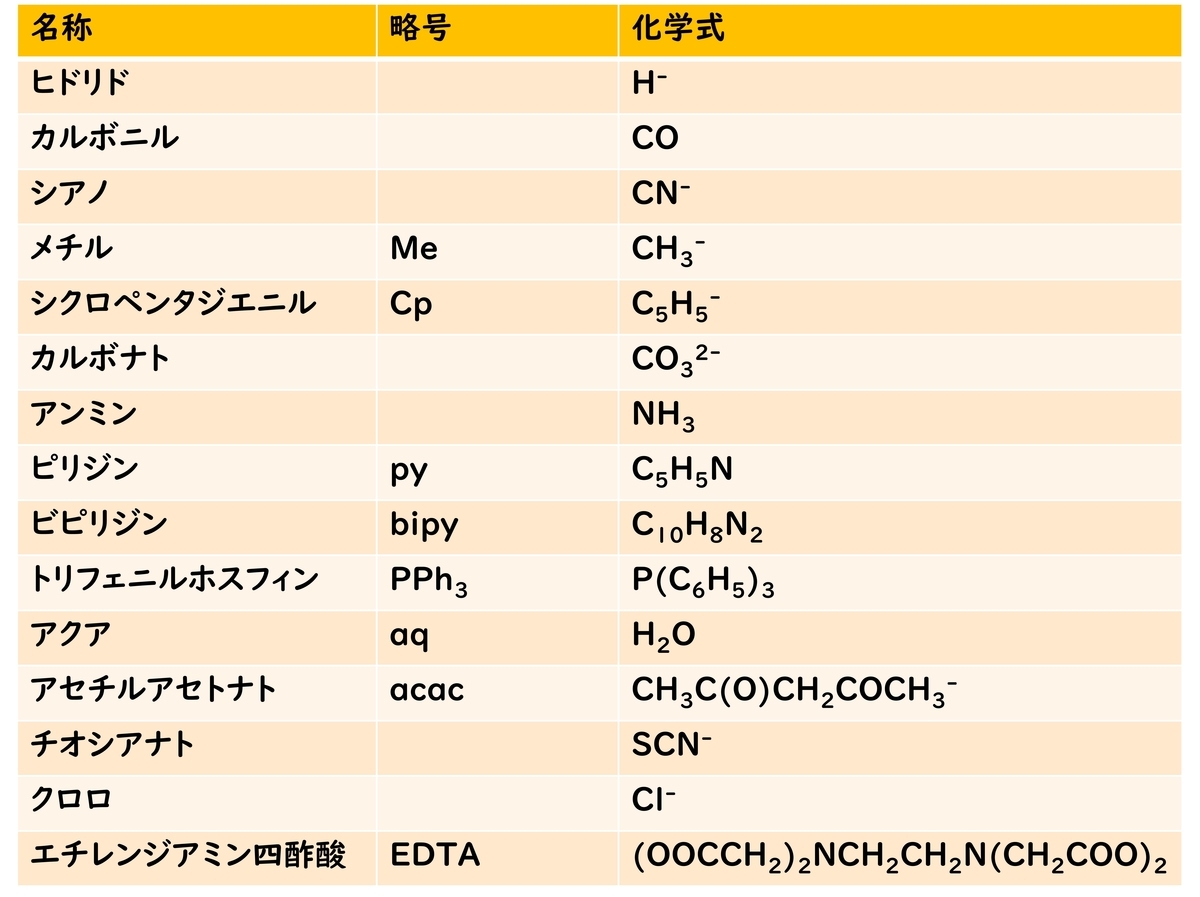
配位子中で金属に配位している原子1つのものを単座配位子、複数のものを多座配位子という。多座配位子はキレート配位子とよばれることも多い。一つの金属に実際に配位している原子の数を、その金属の配位数という。
錯体の配位数と構造
dブロックの遷移金属に配位子が結合して形成する分子性化合物は、錯体もしくは配位化合物とよばれる。金属の配位数は中心金属の大きさ、d電子数、配位子の立体効果などによって決定される。一般的には2~9配位のものがよく知られており、そのなかでも4~6配位の配位構造が電子的にも立体的にも安定であるため、錯体の数も多い。
2配位錯体
電子数の多いd10イオンCu+、Ag+、Au+は直線型の錯イオンを形成する。また非常に立体的にかさたかいとトリシクロハキシルホスフィン(PCy3)の配位した0価の錯体[Pd((PCy3)2]などもよく知られている。
一般的に2配位錯体は後周期遷移金属で安定である。
3配位錯体
[Fe{N(SiMe3)3}3]などが存在しているが、3配位錯体の数は少ない。
4配位錯体
4個の配位子が金属に配位する場合、立体的に最も干渉しあわない配置は正四面体型(tetrahedral)(Td)配位である。しかし、平面正方型(square planar)(D4h)錯体の数も多い。また、同じ配位子だけが配位している平面正方型錯体は数が少ない。
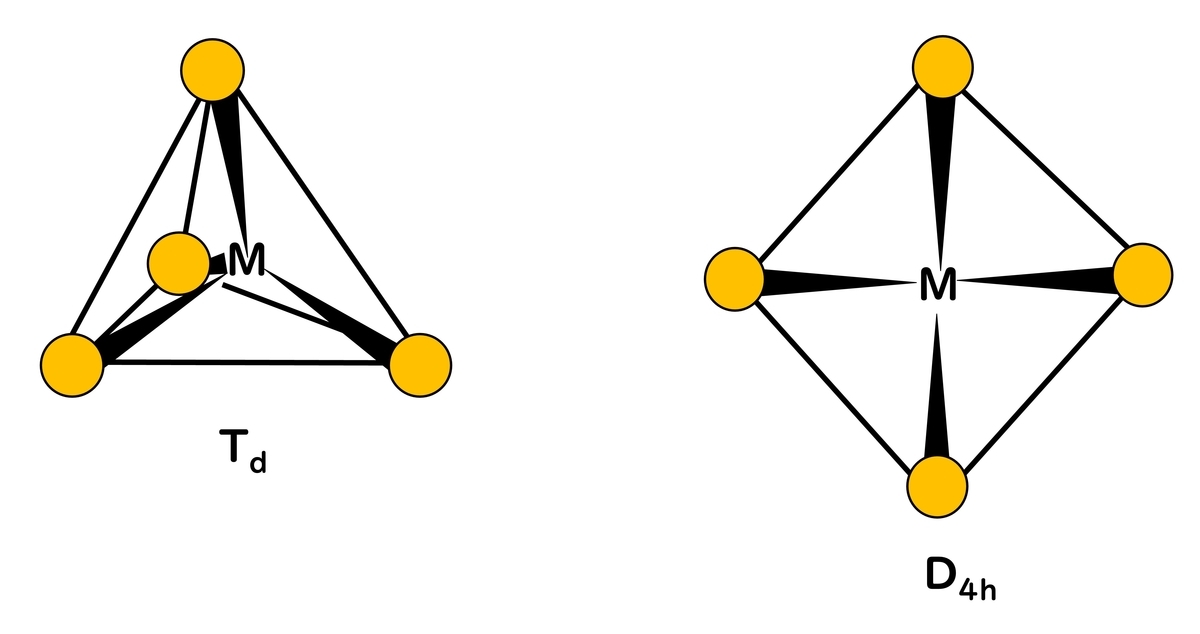
混合配位子錯体の場合、d8イオンであるRh+、Ir+、Ni2+、Pd2+、Pt2+、Au3+などが中心金属の平面正方型錯体が知られている。
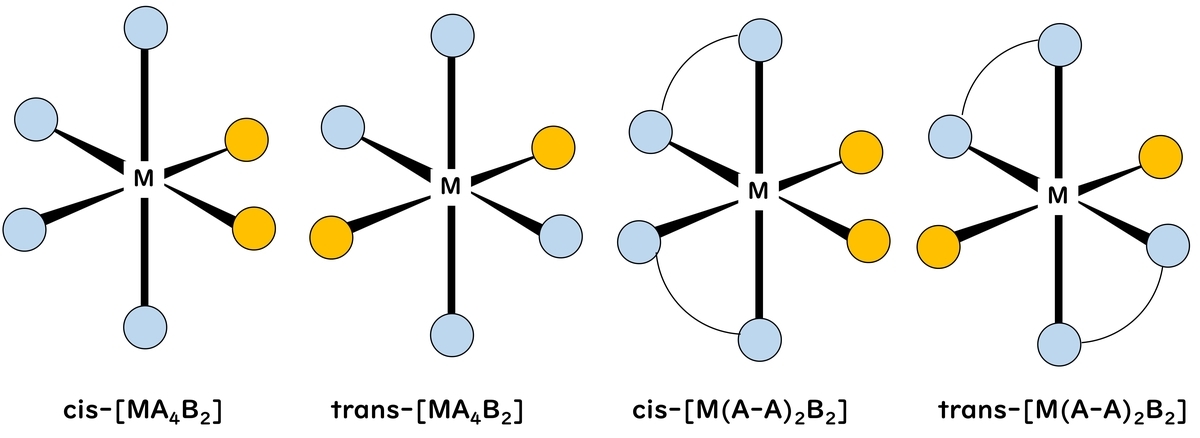
2個ずつ配位子が異なる[PtCl2(NH3)2]ではシスとトランスの幾何異性体が存在する。正四面体型では異性体はできないため、ウェルナーは同組成の2個の異性体を得ることができたとき、構造が平面正方型であることを推定できた。
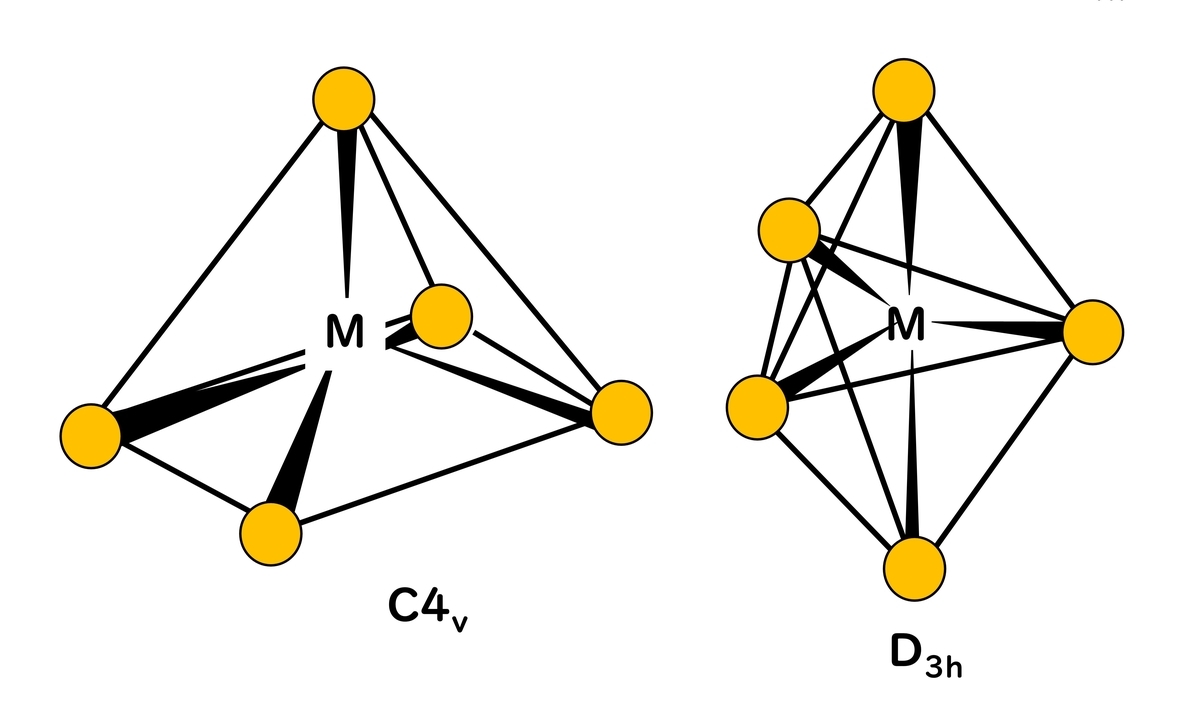
5配位錯体
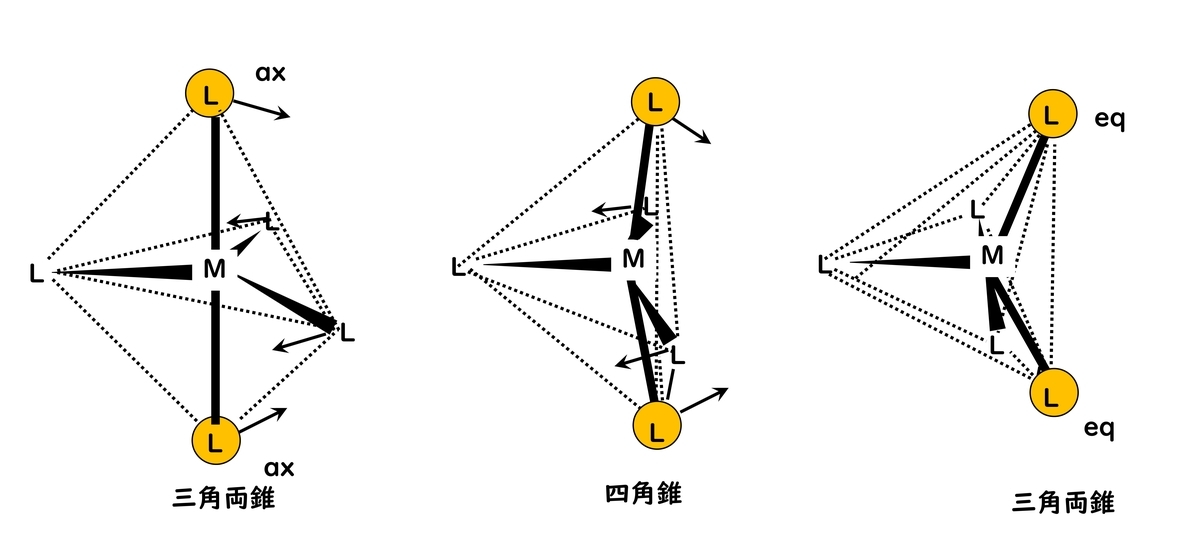
三角両錐型(trigonal bipyramid) (D3h)であるFe(CO)5や四角錐型(square pyramid) (C4V)であるVO(OH2)4などがある。
これらの2つの配位構造の間のエネルギー差は大きくないため、容易に構造変化が起こる。たとえば、Fe(CO)5の分子構造、赤外スペクトルなどは三角両錐型構造に一致するが13C NMRはできる限り低温にしても1本のシグナルしか示さず、NMR固有の観測時間(10-1 ~ 10-9 s)ではアキシャル(axial)とエカトリアル(equatorial)のカルボニル配位子が同等に見えることが知られている。この構造相互変換は四角錐型構造を経由しており、ベリーの疑似回転として知られている。
6配位錯体
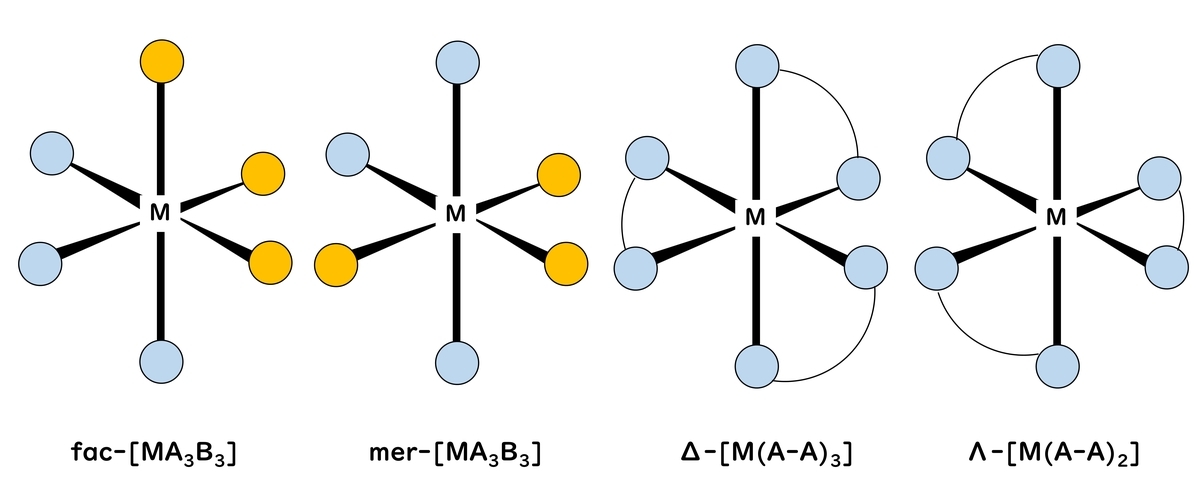
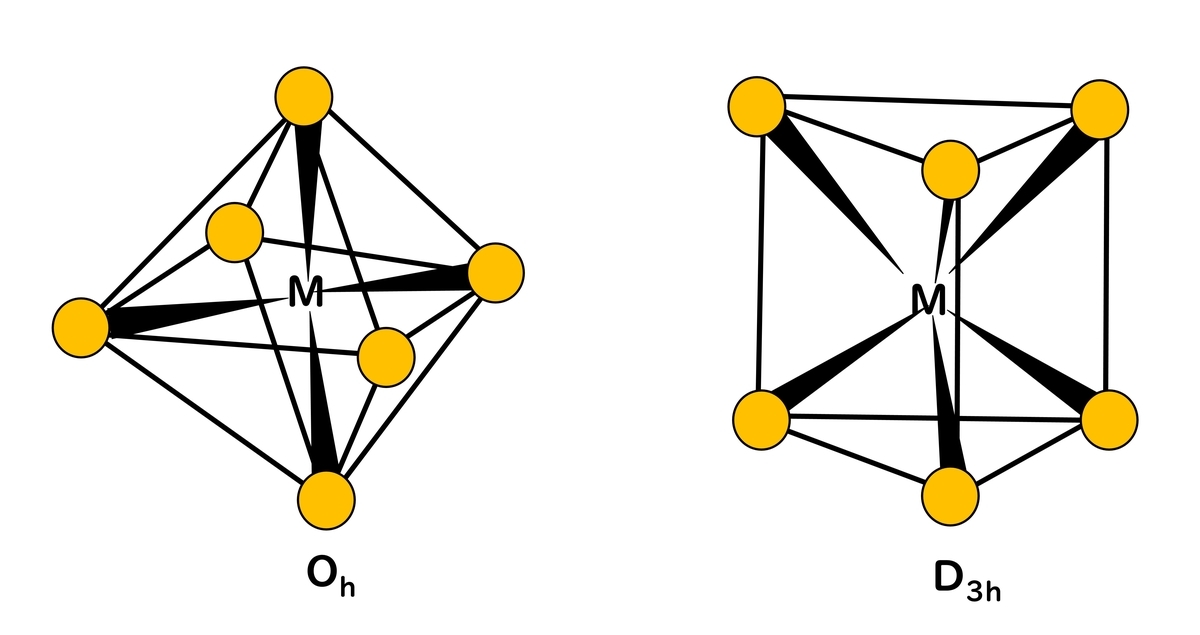
6個の配位子が配位する場合、正八面体型(octahedral) (Oh)配位が最も安定である。そのため正八面体型構造をとる錯体が多い。中でも置換反応に対して安定な[Cr(NH3)6]3+や[Co(NH3)6]3+のようなCr3+やCo3+の錯体の数は非常に多い。配位子の種類が異なる場合には、cis-とtrans-[MA4B2]異性体やmer-とfac-[MA3B3]異性体の幾何異性体が生じ、キレート配位子の場合Δ-[M(A-A)3]とΛ-[M(A-A)3]の光学異性体ができる。
正八面体構造は電子的もしくは立体的要因によって正方(tetragonal) (D4h)、菱面(rhombic)(D2h)、三方(tetragonal)(D3h)歪みを示すようになる。特に[Cu(NH3)6]2+が正八面体から正方歪みを受けることは電子的要因によるものであり、ヤーンテラー効果として知られている。
6個の配位子は三角柱型(trigonal prism)の配位も可能であり、[Zr(CH3)6]2-などが存在するが立体的には正八面体配位のほうが、障害が小さいため、三角柱型の金属錯体の数は少ない。
高配位錯体
第2、3周期の金属イオンは[Mo(CN)8]3-、[ReH9]2-などの7個以上の配位原子を配置できる場合があることが知られている。また、立体的な障害のため、小さい配位子のほうが有利である。