酸化数
化合物、もしくはイオン中において、元素の電気陰性度の大小に応じて、電荷の偏りを極端にした場合の各構成原子の荷電を酸化数という。同じ原子の場合は電荷の偏りがないとみなせるため、酸化数は全体の荷電を原子数で割ったものとする。異なる原子から構成されている化合物やイオンの場合は、電気陰性度が相対的に大きい原子を陰イオンとし、それに対応する陽イオンの組み合わせとして考える。
例えば
N2分子では窒素が0価
O2-2では酸素は-1価
NO2では窒素が+4価、酸素が-2価
NH3では水素が+1価、窒素が-3価
となる。
つまり、相手によって同じ原子でも酸化数が異なる。また、構成原子は酸化数で合わらすことができる酸化状態にあるといえる。
酸化数は実際の電荷の偏り鵜を定量的に表してはいないが、価電子数を数えたり酸化還元反応を取りあつかう際に役に立つ。
酸化還元反応
酸化反応のもともとの考えは担体や化合物が酸素によって酸化物になる反応を意味していた。また還元反応はその逆反応であった。しかし、現在は電子のやりとりで考えられ、電子を与える反応が還元反応であり、電子を失う反応が酸化反応である。
よって、
電子を出す試薬を還元剤、電子を受け取る試薬を酸化剤とよぶ。酸化還元反応の場合、還元剤は酸化され、酸化剤は自身は還元される。
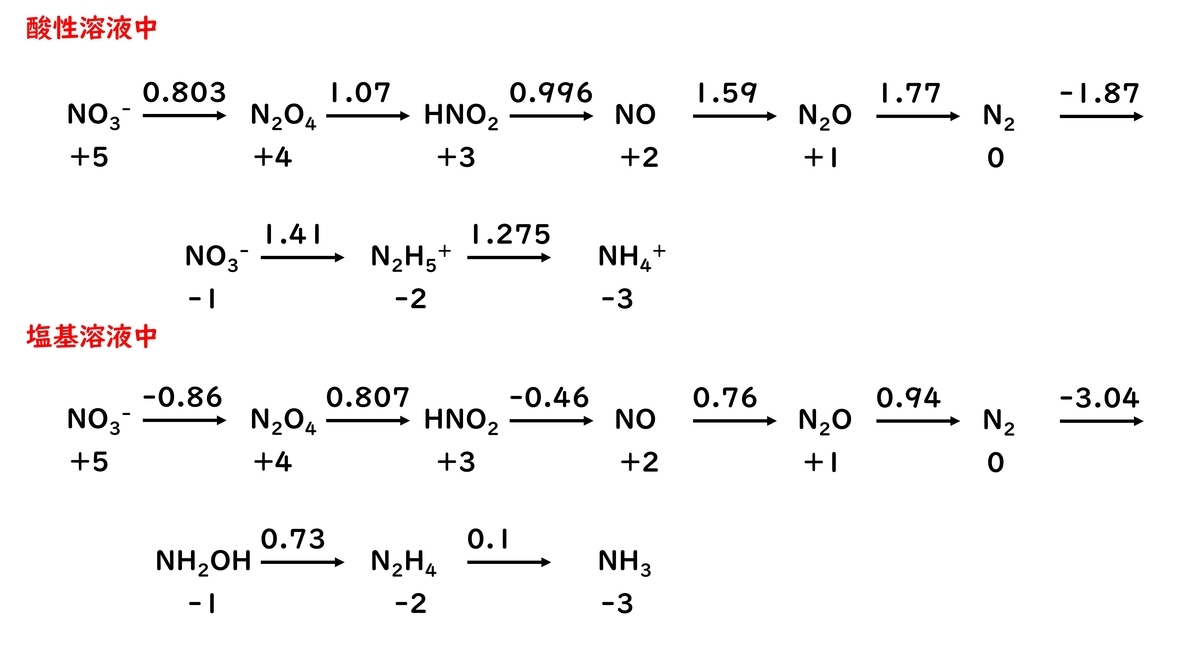
ラティーマーダイアグラム
同じ中心原子をもつ化合種を酸化状態の最高のものを左端におき、右側に酸化状態の順に並べていき、各状態を結ぶ線の上に標準還元電位を書いた図をラティーマー・ダイアグラムという。ラティーマー・ダイアグラムは酸化還元反応の考察を行う際に非常に便利である。
電位は酸性溶液と塩基性溶液でことなるため、それぞれ別の図で示される。
隣接しない酸化状態間の標準還元電位を求めるためには。状態量であるの加成性を利用するとよい。隣接状態間の自由エネルギー変化と電位をそれぞれ
移行電子数を
とすると次のように考えることができる。
つまり、次のようにまとめられる。
例えば酸性溶液中でのNO3-のHNO2への還元反応では、NO3-からN2O4軽油でHNO2生成に2電子が移行するため、下のように考えることができる。
サイクリックボルタンメトリー
新しい無機化合物の酸化還元特性を調べる方法の一つとして、電気化学的測定であるサイクリックボルタンメトリー(CV)がある。サイクリックボルタンメトリーは測定が簡便であるため、酸化、還元の段階数、電位、移行電子数、反応の可逆性などが研究される。
単純に考えると、酸化は化合物から電子を奪うため酸化電位はHOMOのエネルギーレベルに対応し、還元は電子を与えるためLUMOのエネルギーレベルに対応するといえなくもないが、溶媒の効果などさまざまな要因が影響することを考慮する必要がある。