緩衝液と緩衝作用
溶液に酸や塩基を加えたり、溶液を薄めても、pHが大きく変化しない溶液を緩衝液という。
そして緩衝液によるpHを一定に保つはたらきのことを緩衝作用という。
緩衝液は弱酸とその共役塩基、もしくは弱塩基とその共役酸の混合溶液である。
緩衝液のpHの一般式(計算式)
よくある例として、酢酸(HA)と酢酸ナトリウム(BA)の混合溶液、つまり酢酸と酢酸ナトリウムの緩衝液について考える。(Aは酸acidのA、Bは塩基baseのBである)
このとき緩衝液では、以下の平衡が成り立っている。
この溶液に少量の酸を加えると、以下の反応が起こることで、pHはあまり変化しない。
反対に、少量の塩基を加えても、以下の反応が起こるため、pHはあまり変化しない。
このように酸を加えても塩基を加えてもpHがあまり変化しないのが緩衝液による緩衝作用である。
この緩衝液のpHについて考える。緩衝液中には、酢酸()も酢酸イオン(
)も多く存在している。
ここで、酢酸の総濃度を、酢酸ナトリウムの総濃度を
とおく。
この水溶液中では、酢酸イオンの濃度が高いため、反応の平衡を考えると、ルシャトリエの法則によって、反応系の側に傾いているため、酢酸の解離はわずかである。そのため、以下の式が成り立つ。(この[ ]で囲っている場合、その物質の濃度を表す)
一方で、酢酸イオンは弱塩基であるため、塩基解離して生成するもわずかであり、無視することができる。そのため、以下の式が成り立つ。
ここで酸解離の平衡式を考えると、pHは以下のようになる。
よって、上の式によって以下の関係が成り立つ。
この式が緩衝液のpHを表す一般式であり、ヘンダーソン-ハッセルブルクの式ともいわれる。ただし、この式は近似式であり、、
が充分に大きくないと成り立たない。
この式から分かることとして、弱酸と共役塩基の濃度が等しい場合、その緩衝液のpHはと等しくなる。そしてこの条件のときに緩衝作用が最大となる。
一般的に緩衝液が使用できるpH範囲は約程度である。これを酸と塩基の濃度比で考えると、
程度となる。
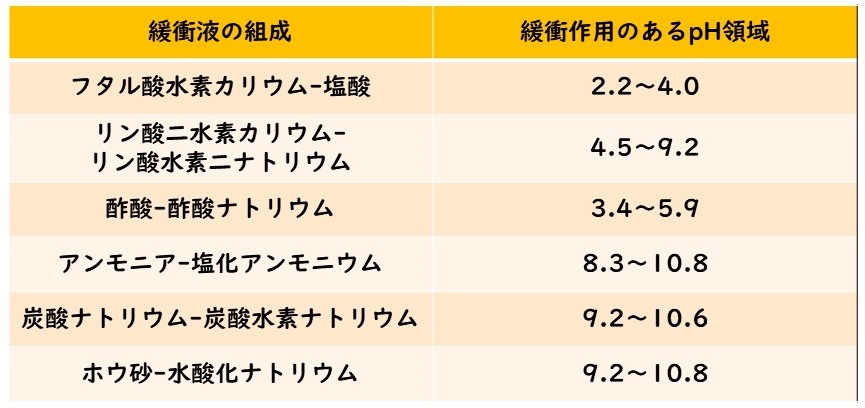
そして、どちらかの成分の濃度が小さくなると、緩衝作用も小さくなる。よって様々なpH範囲に応じて、組成の異なる緩衝液が用いられる。
緩衝液と生体内
生体内では水素イオンは加水分解反応や脱縮合反応などの多くの反応に関わっている。そのため、生命が活動するために、生体内の体液のpHは一定である必要があることから、生体内の体液は緩衝液であることが多い。