水が電解質を溶かす理由
水が電解質を溶かす理由については、未解明な点もあるが、水の大きな誘電率とイオンの水和が主な要因であると考えられている。
比誘電率の効果
距離((m))離れた電荷、
と
(C)の間に働く力
(N)はクーロンの法則で考えることができる。
は真空の誘電率、
は比誘電率であり、電荷がおかれた媒体の性質によって決定する無次元の定数である。
大きな比誘電率をもつ媒体におかれた電荷間に働く力はクーロンの法則に従う。そのため働く力は比誘電率の値の反比例する。一方で、水は大きな比誘電率をもつ液体である。よって、水の中に存在する電荷間に働く力は、他の溶媒と比べると小さくなる。
ここで塩の溶解について考える。塩が溶解する際には、その中の陽イオンが陰イオンの引力を超え、イオン同士をバラバラにする必要がある。水はその大きな比誘電率から、水中ではイオン同士をバラバラにするエネルギーが小さいということが考えられる。よって塩の溶解が有利に進む。
水が大きな比誘電率をもつ理由
比誘電率は、媒体の分極に依存する。分極はその物資が電場中におかれた場合の電荷の偏りを表す。こそのため、分極が大きいほど比誘電率は大きくなる。分極の大きさは電場によって決定された向きの分子の数が増える配向効果による分極(この分極は分子の双極子モーメントの大きさによって決まる)と、物質が電場におかれることによる電子雲が変形する誘起効果による分極の2つの要素による。つまり分極は、分子の双極子モーメントの大きさに依存するため、大きな双極子モーメントをもつ分子は、大きな比誘電率をもつ。さらに、水は、
・水素結合によって水分子の双極子モーメントが打ち消されずに整列し、大きな分子のように挙動する
・水分子のモル濃度が55.5 mol/Lと高い(つまり分子の密度が高い)
・酸素分子の分極率が大きい
などの要因によって、比誘電率がさらに大きくなっていると考えられている。
水和の効果
水和は、イオンと大きな双極子モーメントをもつ水分子との間に静電引力が働くため、水分子の一部が水の規則正しい構造からくずれ、イオンの周りに集まることでイオンが安定化する現象である。
イオンの電荷が大きく、イオン半径が小さいイオンほど強く水和する。
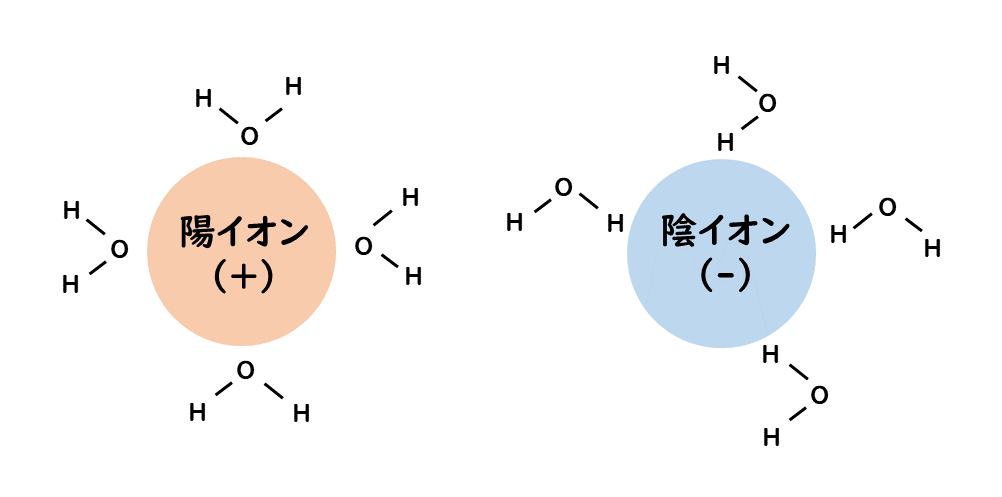
陽イオンでは、水分子中のO原子がよりイオンに近づくが、このときO原子の非共有電子対を陽イオンに供与し、配位結合を形成する。
陰イオンでは、水分子のH原子がよりイオンに近づく。そしてイオンと水素結合を形成して、より安定化する。