カルボン酸の解離と酸性
酢酸CH3COOHのようなカルボン酸RCOOHは、水溶液中では下に示すような化学平衡によって解離し、酸性を示す。
CH3COOH ⇄ CH3COO- + H+
多くのカルボン酸は水に対する溶解度が小さいが、アルコールのような有機溶媒中でも、同じように解離することが知られている。
解離の程度を示す酸解離指数pKaは酢酸で4.86であるように、大きい値ではないが、エタノールなどのアルコールのpKaは17程度であり、アルコールに比べればかなり大きい値を示す。
このカルボン酸とアルコールを比較すると、酢酸の解離指数は12桁ほど小さく、酢酸の解離平衡はエタノールの解離平衡よりも、右辺に偏っている。その理由は共鳴によって説明することができる。解離の結果生じるカルボキシレートイオンCOO-に下の図のような共鳴式を書くことができる。つまり、カルボキシレートイオンが共鳴によって安定化するためであると考えられる。
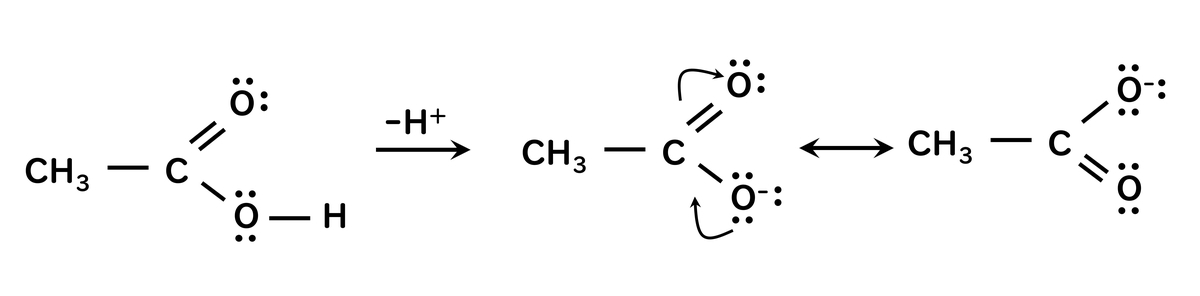
この図では非共有電子対を黒丸で表している。またやじりが二つある曲がった矢印は電子対の移動を表している。
カルボキシレートイオンの共鳴式は酸素に負電荷があり、化学的にも安定なものと考えれる。この2個の共鳴式はベンゼンの2個のケクレ構造共鳴式と比較できる。
一方でエタノールの解離によって称しるエトキシドイオンには、このような共鳴式はないため、特別な安定性ももっていない。