基礎的な系について
物質の熱的な性質を考える場合、考察する対象を系(system)と呼ぶ。
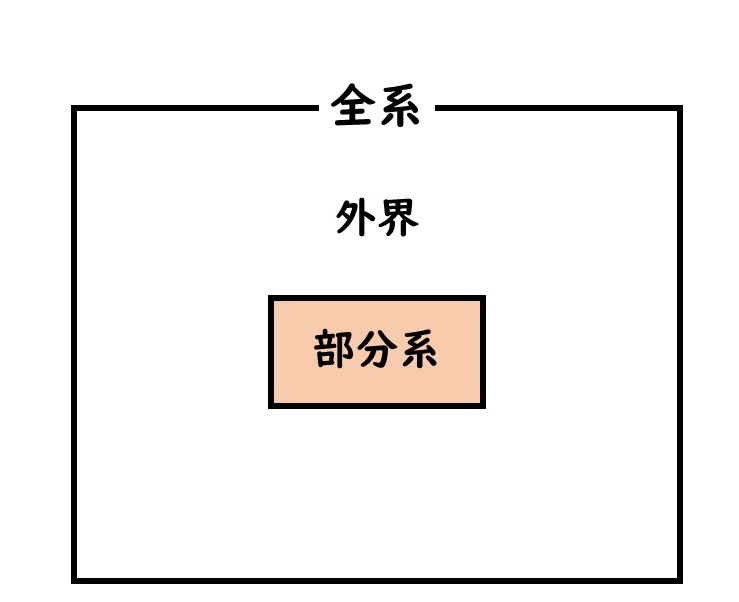
例えばフラスコに試薬が入っている場合を考える。このフラスコを一定の温度に保つためには、恒温槽という装置の中にフラスコを入れる。
このとき、恒温槽のような、着目する系の温度や圧力を決めるものを外界、もしくは環境という。
この恒温槽を含む全体は全系と呼ぶ。フラスコの中のような着目の対象は部分系という。また一般的に外界は十分に大きくて熱平衡状態にあるとみなす。
例えば、温度や圧力、体積といった量をつかって系の巨視的な状態を表す。こういった量で、途中の経路によらない量を状態量という。
逆に熱や仕事は、状態量ではない。
経路によらないとは、たとえば温度が100 ℃の場合には、200 ℃から冷却しても、50 ℃から加熱しても、同じ100 ℃と考えるということである。
状態量は示量的なもの(示量性のもの)と示強的なもの(示強性のもの)の2種類に区別できる。示量的なものは、量を表す。示強的なものは、強さを表す。
体積や物質量は示量的なものであり、圧力や温度は示強的なものである。
示量変数と示強変数の区別の考え方
ある系について、中心に全体を2分割する仕切りが入っており、その体積が同じ両側の空間にそれぞれ気体を同じ量入れ、温度を等しくする。(状態方程式から分かるように、圧力、体積、物質量、温度のうち3つを等しくすると、残りの1つは当然等しくなる。)このとき、中央の仕切り取り除くと、物質量や体積は倍になるが、温度と圧力は変化しない。
このような仮定のときに、物質量や体積のように値が倍になる数値は、示量変数という。温度や圧力のように値が単純に倍にはなっていない数値は、示強変数といわれる。
物理化学や熱力学で扱う様々なエネルギー量は、示量変数である。