共有結合とσ結合・π結合・δ結合
有機物を構成する結合は、ほとんどが共有結合である。共有結合とは、結合する2つの原子が、互いに1つずつ電子を出し、その2つの電子を結合電子雲とする結合である。
簡単にいうと、2つの原子に対して、電子雲がのりとして接着するようなものである
この共有結合は電子軌道の重なりによって構成される。
さらに、この共有結合にはσ結合とπ結合、δ結合という分類がある。
これは結合の電子の重なりが結合軸からどのような対称性をもっているかで区別している。角運動量成分をΛで表すときに、Λが0、1、2の場合をそれぞれσ、π、δと表す。
一般的に有機物の単結合はσ結合である。また、二重結合と三重結合はσ結合とπ結合が組み合わさった結合である。
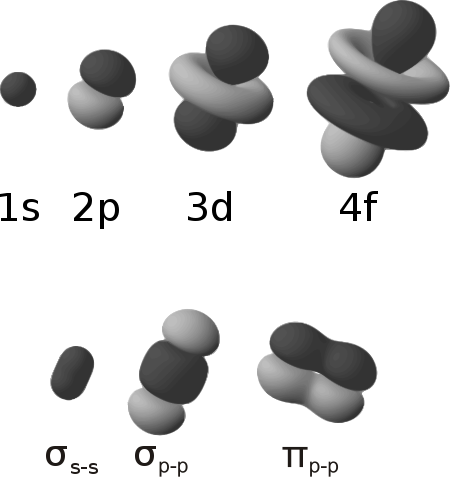
σ結合
2つの原子の間の結合軸に結合電子が分布している結合がσ結合である。また、σ結合の結合電子をσ電子、入っている軌道をσ軌道という。
水素分子では水素原子の1s軌道同士の重なりでσ結合が形成される。
また、炭素原子などでx軸が分子軸である場合は、px軌道同士や、s軌道とpx軌道の重なりでσ結合が形成される。また、z軸が分子軸の場合には、d2z軌道とs軌道でσ結合が形成されることがある。
有機物の骨格はこのσ結合によって形成されていることが多い。
σ結合では、片方の原子を固定したまま、もう一方の原子を回転しても結合は変化しない。そのためσ結合は結合回転可能である。
π結合
結合軸に対して直角方向のp電子は結合軸からみて上部と下部に電子雲が広がっているが、この両方の電子雲がくっつくことで重なり形成される結合がπ結合である。また、π結合の結合電子をπ電子、入っている軌道をπ軌道という。
例えば2つのpz軌道がx軸上を動いていくと、pz軌道同士が平行のまま近づいていく。そして、pz軌道の両方の電子雲が重なる。こうして形成される結合がπ結合である。
このため、π結合の電子雲は結合軸の上下2箇所に生じる。そのため、π結合では、片方の原子を固定したまま、もう一方の原子を回転させると、π結合電子雲が壊れることになり、π結合は切断される。このようにπ結合は結合回転可能ではない。
また、原子軌道の重なりもσ結合よりもπ結合の方が小さく、そのためπ結合はσ結合よりも弱い結合となる。
原子の電子軌道およびσ結合、π結合の形
δ結合
δ結合は特に遷移金属原子間に見られる多重結合の一つである。結合方向をz軸とすると、dxy軌道とdxy軌道の間やdx2-y2軌道とdx2-y2軌道の間で形成される結合である。