セリワノフ反応
セリワノフ反応 (Seliwanoff's test or Seliwanoff's reaction) はケトースとアルドースを識別する呈色反応である。
セリワノフはロシアの化学者 Feodor Feodorovich Selivanovに由来している。
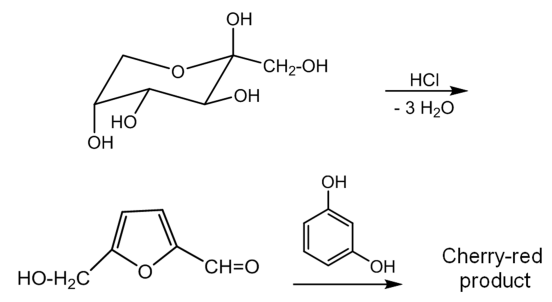
糖のうち、ケトン基を含む糖はケトースであり、アルデヒド基を含む糖はアルドースである。セリワノフ反応を用いた試験では、試料にレソルシノールと塩酸を加え、湯浴上で加熱すると、多糖類やオリゴ糖のケトース酸で加水分解され、より単純な糖となる。この糖を加熱したときにケトースはアルドースよりも急速に脱水しフルフラール誘導体 (5-ヒドロキシメチルフルフラール) となることを利用する。さらに、脱水したケトースは塩酸中で2当量のレゾルシルと縮合すると赤色の生成物が得られる。そのため呈色によってケトースとアルドースの識別が可能となる。
図1 セリワノフ反応の反応式
引用:参考文献
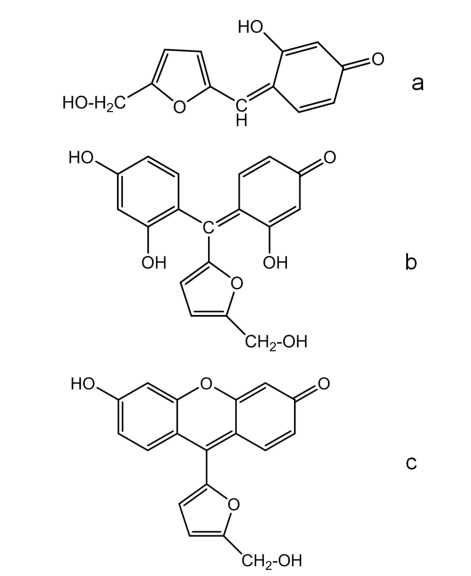
赤色の化合物 (Cherry-red product)の構造はいくつか提案がされている。最も単純な構造は2環のセミキノン構造(図2a)である。他に提案されている構造は、2つのレゾルシノール分子を含んだ構造であり、3環の誘導体(図2b)が提案されている。また古典的に提案されていた構造としては図2cの構造がある。
図2 赤色化合物の構造式
引用:参考文献
ケトヘキソースの場合、赤色へのシフトはフラン誘導体に存在する5-ヒドロキシメチル基によるものである。
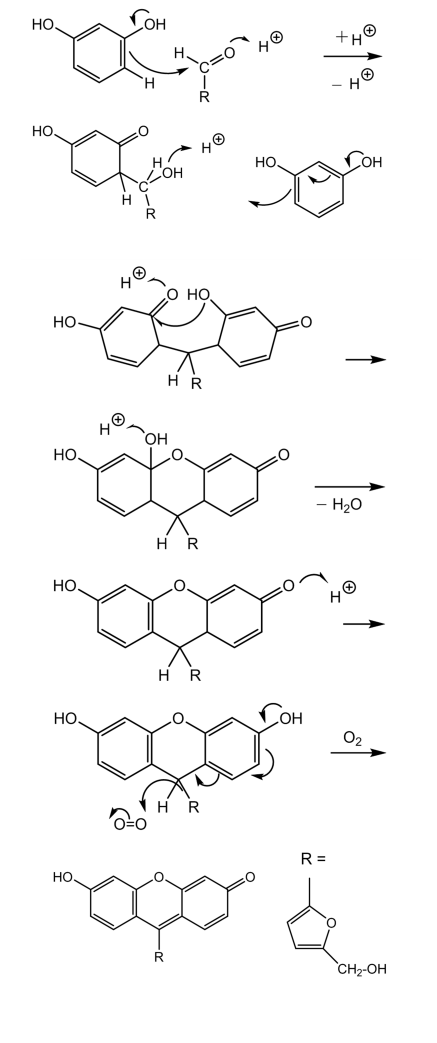
最終生成物が合成される反応機構としては、昔から提案されていたものとして図3に示すものが提案されている。
図3 最終生成物が生成する反応機構
引用:参考文献
ケトースと比べると、アルドースはセリワノフ反応が進みにくいとされている。そのためアルドースを含む溶液は反応が遅く淡いピンク色が観察される。
このことから、色以外に、反応時間からもケトースとアルドースを識別することができる。
セリワノフ反応に用いられる試薬はレソルシノール(レゾルシノールともいう)と濃塩酸である。塩酸は6M HClや4M HClなどが用いられることが多い。
セリワノフ反応の応用
セリワノフ反応は当初、フルクトースに対する呈色反応として報告された。その後、ケトヘキソースにも応用され、ケトヘキソースでは濃い桜色を呈する。またケトペントースにも応用され、青緑色を呈する。
他に、発酵培地中のフルクトースをセリワノフ反応を用いて呈色し、比色定量する方法も報告されている。
フルクトースの同定に関連したものとしては、氷酢酸中のフルクトースを硫酸を含むフェノール溶媒で処理し、湯浴によって加熱すると緑色に呈色する方法もある。この試験ではフルクトースを生成する物質においても呈色を示す。
ケトヘキソースがアルドヘキソースよりも速く脱水する理由についての報告
ケトヘキソースがアルドヘキソースよりも速く脱水することを考えるためには、反応機構を考える必要があるが、反応機構については、いくつか提案がされている。
ここでは参考文献1に掲載されている順序に従って、各反応機構を示していく。
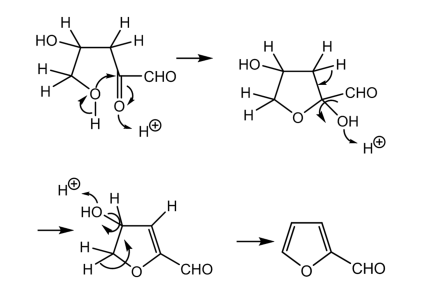
以前提唱されていたフルフラールの生成機構
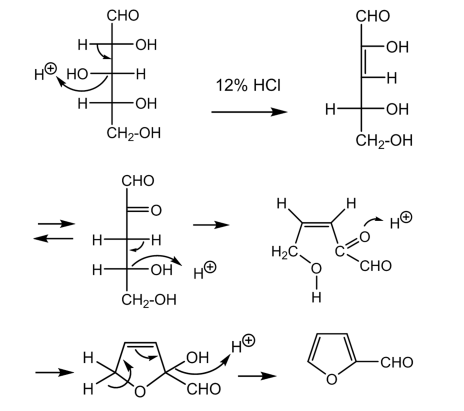
フルフラールの生成の反応機構では、ペントースの開口構造の部分から反応が始まると考えられていた。そしてアルドペントースからエノールを経由してα-ケトアルデヒドに脱水し、2回目の脱水反応によってα,β-不飽和ケトンが得られ、最後に酸触媒による環化反応と脱水反応によってフルフラールが得られる。
これを示したものが図4である。
図4 脱水反応の反応機構
引用:参考文献
ただし、この反応機構については、懸念点が指摘されている。まず、開鎖構造をもつ分子の割合が非常に低いことである。
またプロトンへの水酸化物の生成が起こらないにもかかわらず、水酸化物のプロトン化によってオキソニウムイオンが生成し、水が脱離している機構も誤りである可能性が高い。
さらに、提案されている二重結合は環化しにくいトランス生成物が得られることになる。
そこで、他の案として図5のように、二重結合の前に環化が起こり、その後ヘミケタールでジヒドロフラン環に対して脱水し、最後に2-フルアルデヒドに脱水する案がある。しかしながら、この案も開鎖構造から起こるという部分は変わらない。
図5 二重結合生成前に環化が起こる反応機構
引用:参考文献
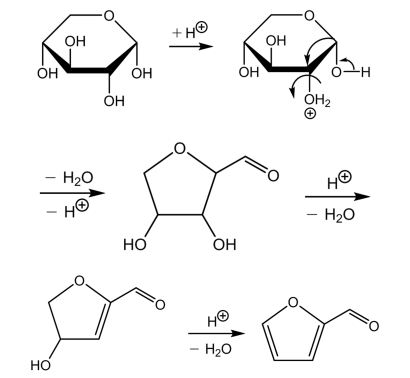
最近提案されたフルフラールの生成の反応機構
2010年の論文では、ペントースからフルフラールの形成は、ピラノース環のC-2位のOのプロトン化によって、ペントースからピラノース型から開始すると考えられている。
α-D-キシロピラノースからフルフラールが得られる反応を図6に示す。
図6 α-D-キシロピラノースからフルフラールへの反応機構
引用:参考文献
この場合、水分子が取り除かれた後、環の縮小が起こり、カルボカチオンの中和によってアルデヒドに異性化するエノールが生成される。このテトラヒドロフラン誘導体は2, 5-無水物であり、分子内のエーテルの形成に関する2つのヒドロキシ基をもつ構造である。2回目の脱水によって、α, β-不飽和化合物が得られ、3回目の脱水によってフルフラールが得られる。
セリワノフ反応ではグルコースの反応がフルフラールの反応よりも遅いこと
セリワノフ反応では、グルコースの反応はフルクトースよりも遅い。この遅れはグルコースのフルクトースへの異性化以前に理由があると考えられる。
実際、D-グルコースからD-フルクトースへの酸触媒異性化中にC-2位からC-1位への分子内の水素の移動が起こることが報告されている。
図7にβ-D-グルコピラノースからα-D-フルクトフラノースへの反応を示す。これは硫酸塩およびリン酸塩といった酸のナトリウムもしくはカリウム塩を用いて、セルロースを5-ヒドロキシメチルフルフラールに直接分解する反応機構であり、緑色のヒドロキシメチルフルフラールが生成物として得られる。
図7 β-D-グルコピラノースからα-D-フルクトフラノースへの反応
引用:参考文献
ルイス酸によるグルコースからフルクトースへの他の異性化についてもC-2位からC-1位への同じ水素化物の移動が起こると報告されている。
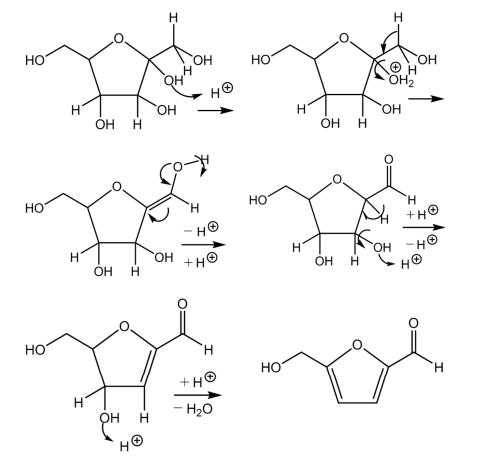
次にフルクトースからヒドロキシメチルフルフラールへの脱水反応の機構を図8に示す。
図8 フルクトースからヒドロキシメチルフルフラールへの脱水反応の機構
引用:参考文献
フルクトースの5-ヒドロキシメチルフルフラールへの脱水はフルクトフラノース型を介して起こる。これは、グルコースのフルクトースへの異性化、もしくはフルクトピラノース型からのもっと直接的な変化によって起こる可能性がある。脱水反応はヘミケタールで始まり、中間体のエノールはアルデヒドに転位する。その後、2回目の脱水によってα, β-不飽和誘導体が得られ、3回目の脱水によってヒドロキシメチルフルフラールが得られる。
最後にグルコースから5-ヒドロキシメチルフルフラールへの反応機構について図9に示す。
図9 グルコースから5-ヒドロキシメチルフルフラールへの反応機構
引用:参考文献
この反応機構はキシロースなどのペントースから、C-2位のOでのプロトン化、水分子の除去、環の縮小、中和、脱プロトン化、2回以上の脱水によってフルフラールへと反応する。
また、開鎖グルコースの脱水反応の経路は、β-グルコピラノースもしくはフルクトースへの異性化と比べて優先されないことが、計算化学の研究からも報告されている。
椅子型の配座異性体は、環縮小の機構で5-ヒドロキシメチルフルフラールとなる。
反応機構の違いについてのまとめ
結論として、フルクトースからヒドロキシメチルフルフラールへの反応を見ると、脱水は、より反応性の高いOHであるアノマー(ピラノースやフラノースが環状構造をとる際の立体異性体の1つ)のプロトン化によって開始される。アノマーはビシナル(2つの隣接する炭素原子に結合した2つの置換基)の脱プロトン化まで、共鳴構造によって安定している。
次に互変異性が起こり、テトラヒドロフラン誘導体の2回の脱水によってヒドロキシメチルフルフラールが生成される。最初の脱水は、α, βの共役と考えることができ、互変異性の前はエノールの電子供与によってアリルOHの非常に急速な脱水が起こると考えられる。
一方で、グルコースから5-ヒドロキシメチルフルフラールでは、最初のプロトン化は最も塩基性のOHではなく、C-2位のOで起こる。次に、カチオン転位収縮によって5員環の中間体が生成する。そして2回脱水反応が起こることで、ヒドロキシメチルフルフラールが得られる。
この経路では開始点と環の収縮という2つ点が反応性が低く、反応が起きにくい。またヒドロキシメチルフルフラールへの別の経路であるグルコースからフルクトースへの異性化も、反応性の低い水素化物シフトが存在する。
さらに、全体の反応経路を見ると、ヒドロキシメチルフルフラールへの多くのステップと、それによる多くの反応時間が必要となると考えられる。
このようにセリワノフ反応ではケトースはアルドースよりも多くの反応機構を介して反応が起こるという違いから、反応の起こりにくさや反応時間の長さが説明できる。
参考文献
Sánchez-Viesca, Francisco, and Reina Gómez. "Reactivities involved in the Seliwanoff reaction." Modern Chemistry 6.1 (2018): 1-5.