遷移金属錯体の結合
金属d軌道と配位子軌道の相互作用の結果、結合性、非結合性、反結合性の錯体分子軌道が形成される。一般に配位子軌道の方が金属結合より低いエネルギー準位にあるため、結合性軌道は配位子性が大きく、非結合性および反結合性軌道は金属性が大きくなる。
σ性とπ性の分子軌道の形成について考えると次のようになる。
σ結合
直行座標系の原点に金属を、座標方向に配位子を配置し、金属のs、p、d軌道と配位子の軌道の相互作用のうち、M-Lのσ結合を考える。σ結合は結合軸方向に節がない結合である。そのため、配位子のσ性の軌道と、+、-の符号で表される対称性、軌道の形が適合する場合は、金属のs結合(a1g、非縮退軌道)、px、py、pz軌道(t1u、三重縮退軌道)、dx2-y2、dz2軌道(eg、二重縮退軌道)である。図にすると次のようになる。
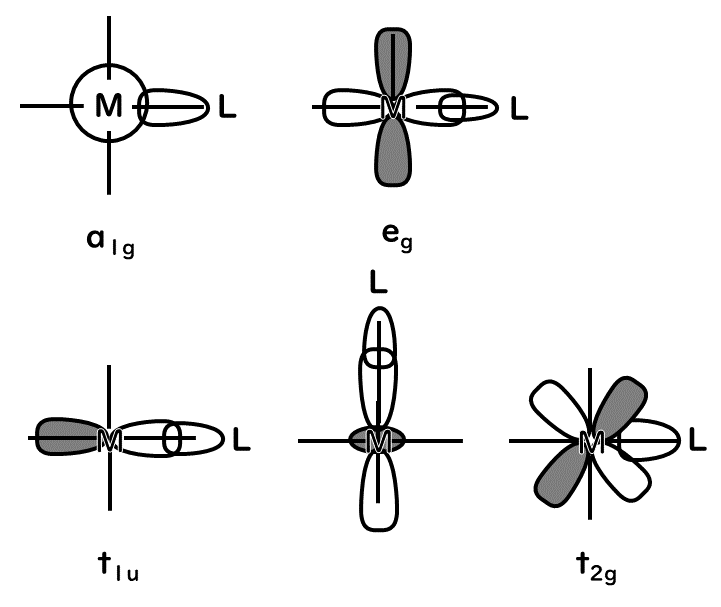
そこで配位子の軌道をそれぞれ、x軸方向の配位子の軌道をσ1、σ2、y軸方向のものをσ3、σ4、z軸方向のものをσ5、σ6とすると、6つの配位子の原子軌道を金属の対称性に合わせて、線形結合によって整理することができる。この場合、金属のa1g軌道と合う軌道はa1g(σ1+σ2+σ3+σ4+σ5+σ6)、金属のt1u軌道と合う軌道はt1u(σ1-σ2、σ3-σ4、σ5-σ6)、金属のeg軌道と合う軌道はeg(σ1+σ2-σ3-σ4、2σ5+2σ6-σ1-σ2-σ3-σ4)である。金属のeg軌道と配位子のグループ原子軌道の間には結合性相互作用が働く。この結合性相互作用によって、結合性軌道と反結合性軌道が形成される。この関係を表すと次の図のようになる。
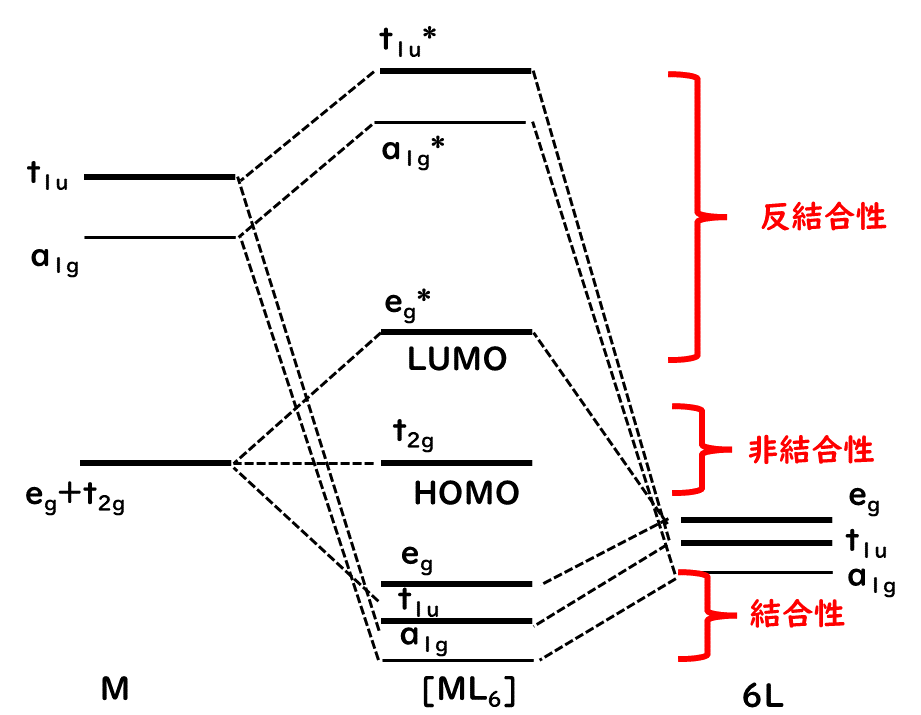
形成した分子軌道はエネルギーの低い順に(a1g、t1u、eg)、非結合性(t2g)、反結合性(eg*、a1g*、t1u*)となる。
たとえば、[Co(NH3)6]3+といった錯体の場合であれば、電子はコバルトから6つ、アンモニアから12つの計18つの価電子が軌道の下から順番に入っていき、9つの軌道に入るため、t2gがHOMO、eg*がLUMOとなる。このHOMOとLUMOの間のエネルギー差が配位子場分裂に対応する。そのため、egセット(dx2-y2、dz2軌道)と配位子正八面体の頂点に位置する配位子とは結合性のσ結合が形成できる。しかし、t2gセット(dxz、dyz、dzx)は配位子のσ性の軌道の方向を向いていないため、非結合性となる。
π結合
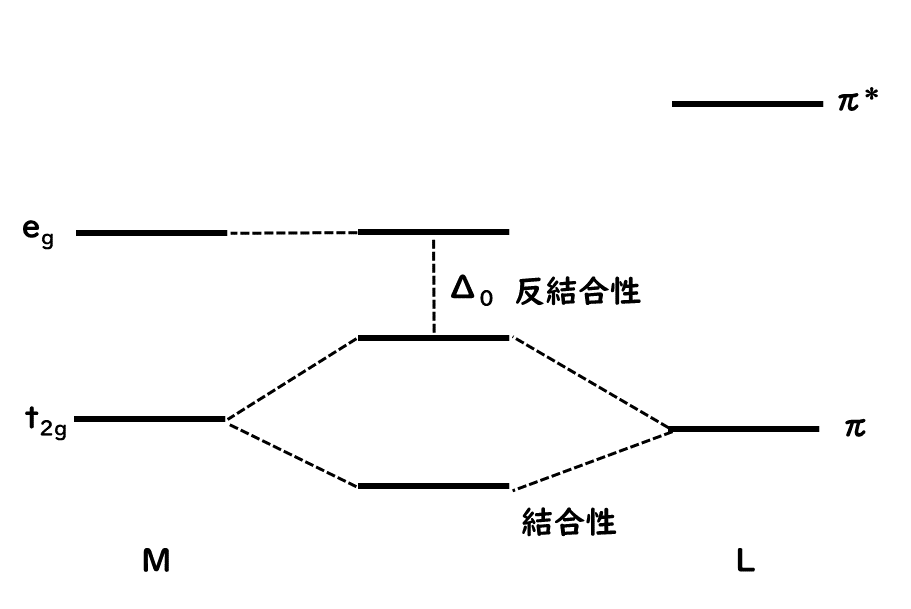
配位子Lの原子軌道が金属との結合軸については、πの対称性、つまり軌道が節をもつ場合は、eg軌道(dx2-y2、dz2軌道)は非結合性であるため、t2g軌道(dxz、dyz、dzx)と結合性の相互作用ができる。これを図にすると次のようになる。
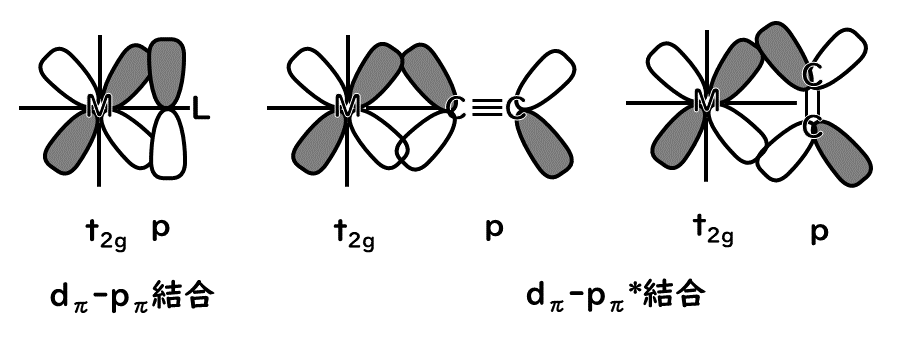
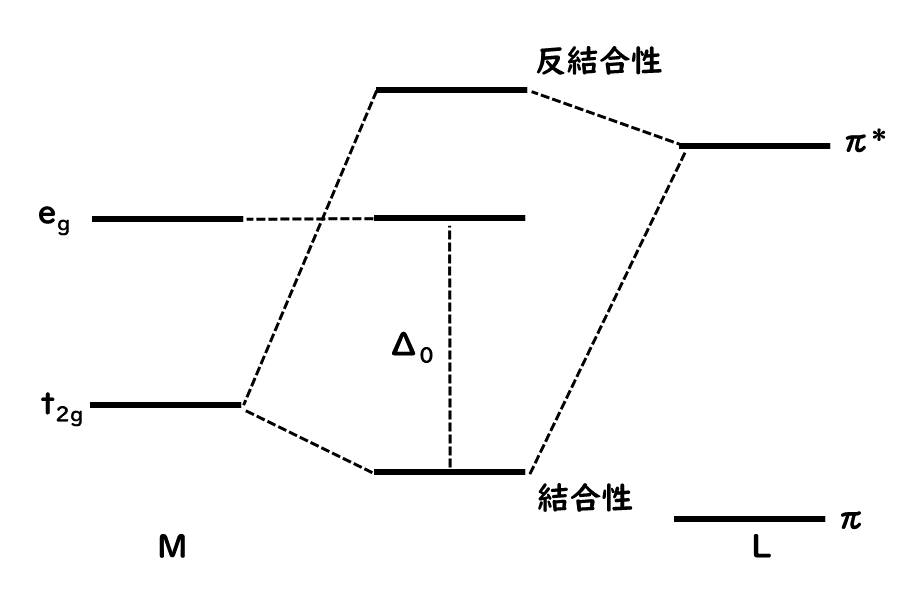
ハロゲン化物イオンX-やアクア配位子H2Oなどでは、π対称性の軌道より低いエネルギー準位にある。そのため、軌道間の相互作用によってt2g軌道より低い結合性分子軌道とt2g軌道とのエネルギー差Δoが小さくなる。一方、一酸化炭素やエチレンのような分子内に反結合性π軌道を持つ配位子ではπ*軌道がt2g軌道と軌道の形が対称性が合うため、下図のような分子軌道が形成できる。このため、t2g軌道由来の結合性軌道が下がり、Δoが大きくなる。