形式電荷とは
分子の電子式で、共有結合に関与する電子を、結合している原子に均等に割りふったときに、各構成原子がもつ見かけ上の電荷のことを形式電荷 (formal charge) という。
形式電荷の計算方法
分子中のある原子に割り当てられた正負の整数の電荷である形式電荷は、次の式によって計算できる。
(原子の形式電荷) = (遊離原子の価電子数) - 2 × (非共有電子対の数) - (結合電子対の数)
遊離原子の価電子数とは、注目している原子が他の原子と結合していない場合の価電子数のことである。
計算式では、非共有電子対 (孤立電子対、ローンペア) の数、結合電子対 (共有電子対) の数であり電子そのものの数ではないことに注意が必要である。
形式電荷の計算例
例として一酸化二窒素の各原子の形式電荷を考える。今回は、次のような構造の場合について計算する。
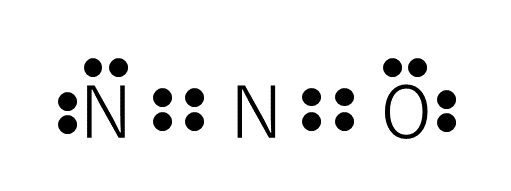
まず、左端のNについて考える。Nは価電子数は、5である。また、非共有電子対は2つである。結合電子対も2つである。よって、次のように計算できる。
(左端のN原子の形式電荷) = 5 - 2 × 2 - 2 = -1
中央のNについて考える。Nの価電子数は5である。また、非共有電子対は0つである。結合電子対は4つである。よって、次のように計算できる。
(中央のN原子の形式電荷) = 5 - 2 × 0 - 4 = +1
右端のOについて考える。Oの価電子数は6である。また、非共有電子対は2つである。結合電子対は2つである。よって、次のように計算できる。
(右端のO原子の形式電荷) = 6 - 2 × 2 - 2 = 0
よって、形式電荷を上の構造に記入すると次のようになる。
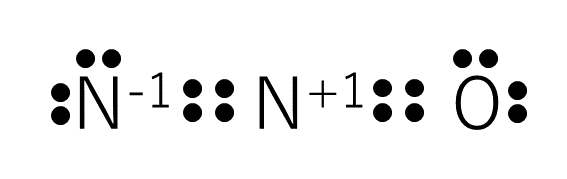
形式電荷と酸化数
形式電荷は、2つの原子間に純粋な共有結合を仮定した場合の考え方である。一方で、結合に関わる電子を電気陰性度の高い方の原子に属すると仮定し、そのときの擬似的なイオンの電荷を数えたものが酸化数である。酸化数は、結合に純粋なイオン結合を想定するため、無機化合物の電子分布を定性的に評価する場合に適している。